संयुगांची निर्मिती
व्याख्या:- ज्या मूलद्रव्यांच्या बाह्यतम कक्षा अपूर्ण असतात. अशी मूलद्रव्ये रासायनिक अभिक्रिया करून स्थिर इलेक्ट्रॉन संरुपण प्राप्त करतात म्हणजेच बाह्यतम कक्षा पूर्ण करतात. त्या रासायनिक अभिक्रिया दोन प्रकारे घडून येतात.
1) इलेक्ट्रॉन ची देवाणघेवाण 2) इलेक्ट्रॉनची भागीदारी
1) इलेक्ट्रॉन ची देवाणघेवाण
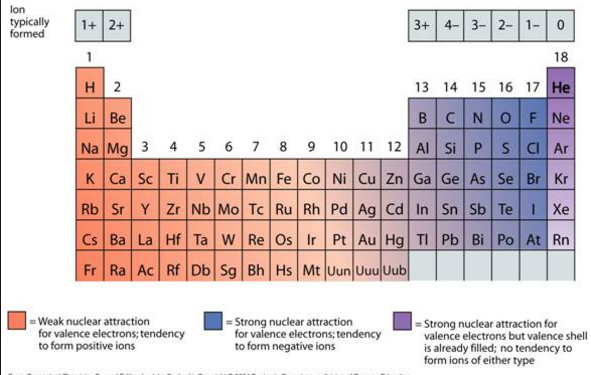
इलेक्ट्रॉनची देवाणघेवाण धातू आणि अधातू यामध्ये होते.
धातूंच्या बाह्यतम कक्षेत 4 पेक्षा कमी इलेक्ट्रॉन असल्यामुळे ते इलेक्ट्रॉन गमावतात आणि अधातूंच्या बाह्यतम कक्षेत 4 पेक्षा जास्त इलेक्ट्रॉन असल्यामुळे ते इलेक्ट्रॉन कमावतात
धातु (Metal):
आपल्या बाह्यतम कक्षेतील इलेक्ट्रॉन गमावून धन आयनांची निर्मिती करतात त्यांनाच कॅटायन असे म्हणतात आणि धातूंचा या गुणधर्माला विद्युत धन गुणधर्म असे म्हणतात
अधातू (Non-Metal):
आपल्या बाह्यतम कक्षेत इलेक्ट्रॉन कमवतात आणि ऋण आयनांची निर्मिती करतात. त्यांनाच अॅनायन असे म्हणतात आणि अधातूंच्या या गुणधर्माला विद्युतऋण गुणधर्म असे म्हणतात.
2) इलेक्ट्रॉनची भागीदारी
समान किंवा भिन्न अधातूमध्येच इलेक्ट्रॉनची भागीदारी होते. समांतर धातूमध्ये भागीदारी झाल्यास रेणू तयार होतात तर भिन्न अधातूमध्ये भागीदारी झाल्यास संयुगे तयार होतात.
अधातूमध्ये भागीदारी होताना त्यांच्या बाह्यतम कक्षा जोडल्या जातात. त्यानंतर प्रत्येक अधातू बाह्यतम कक्षा पूर्ण करण्यासाठी लागणारे इलेक्ट्रॉंन भागीदारीमध्ये वापरतात आणि ते इलेक्ट्रॉन दोन्ही मूलद्रव्यासाठी सामाईक असतात.
रासायनिक बंध:
संयुगातील तसेच रेणूतील दोन किंवा अधिक अणूंना एकत्र बांधून ठेवण्यासाठी कारणीभूत असलेल्या आकर्षण शक्तीला रासायनिक बंध असे म्हणतात.
रासायनिक बंध इलेक्ट्रॉनची देवाण-घेवाण होऊन किंवा इलेक्ट्रॉनची भागीदारी होऊन तयार होतो त्यानुसार रासायनिक बंधाचे दोन प्रकार पडतात.
1) आयनिक बंध:
दोन किंवा अधिक धातू – अधातू मध्ये इलेक्ट्रॉन ची देवाण-घेवाण होऊन तयार होणाऱ्या रासायनिक बंधास आयनिक बंध किंवा विद्युत संयुज बंध म्हणतात.
उदा: सोडियम क्लोराईड, मॅग्नेशियम ऑक्साईड
सोडियम अणूचे इलेक्ट्रॉन संरुपण 2, 8, 1 असून क्लोरीन अणूचे इलेक्ट्रॉन संरुपण 2, 8, 7 आहे.
सोडियम आपल्या बाह्यतम कक्षेतील एक इलेक्ट्रॉन क्लोरीनला देतो, व दोघांच्या बाह्यतम कक्षेत पूर्ण होऊन अष्टक स्थिती प्राप्त होते.
सोडियम ने एक इलेक्ट्रॉन गमावल्यामुळे धन आयनाची निर्मिती होते, त्यालाच सोडियम आयन असे म्हणतात. तर क्लोरीनने एक इलेक्ट्रॉन कमावल्यामुळे ऋण आयनांची निर्मिती होते त्यालाच क्लोराईड आयन असे म्हणतात.
तसेच त्यांच्यातील या रासायनिक बंधाला आयनिक बंध असे म्हणतात.
2) सहसंयुज बंध
दोन किंवा अधिक अधातूमध्ये भागीदारी होऊन तयार होणाऱ्या रासायनिक बंधास सहसंयुज बंध असे म्हणतात.
दोन हायड्रोजनच्या अणूमध्ये इलेक्ट्रॉनची भागीदारी होऊन हायड्रोजन रेणू तयार होतो.
हायड्रोजन व क्लोरिन मध्ये इलेक्ट्रॉन ची भागीदारी होऊन हायड्रोजन क्लोराईड तयार होते.
भागीदारी करतांना त्या अधातूंच्या बाह्यतम कक्षा जोडल्या जातात व त्यानंतर त्या अधातूंना स्थिर होण्यासाठी आवश्यक असणारे इलेक्ट्रॉन भागीदारीमध्ये वापरतात.
भागीदारीतील इलेक्ट्रॉन दोन्हीही अधातूंसाठी सामाईक असतात.
बाह्यतम कक्षेलाच संयुजा कक्षा असे म्हणतात. तसेच त्यांच्यातील रासायनिक बंधाला सहसंयुज बंध असे म्हणतात.
समान व भिन्न अधातू मध्ये भागीदारी मध्ये किती इलेक्ट्रॉन भाग घेतात त्यानुसार सहसंयुज बंधाचे तीन प्रकार पडतात.
1) एकेरी सहसंयुज बंध
समान किंवा भिन्न अधातूमध्ये दोन इलेक्ट्रॉनची किंवा एका जोडीची भागीदारी होऊन तयार होणाऱ्या बंधाला एकेरी सहसंयुज बंध असे म्हणतात. या बंधाला ‘-’ या चिन्हाने दर्शवितात.
2) दुहेरी सहसंयुज बंध
समान किंवा भिन्न अधातूमध्ये चार इलेक्ट्रॉनची किंवा दोन जोडीची भागीदारी होऊन तयार होणाऱ्या बंधाला दुहेरी सहसंयुज बंध असे म्हणतात. या बंदला बंधाला ‘=’ या चिन्हाने दर्शवितात.
3) तिहेरी सहसंयुज बंध
समान किंवा भिन्न अधातू मध्ये सहा इलेक्ट्रॉनची किंवा तीन जोडीची भागीदारी होऊन तयार होणाऱ्या बंधाला तिहेरी सहसंयुज बंध असे म्हणतात.
याबंधाला ‘==’ या चिन्हाने दर्शवितात.
आयनिक संयुगे आणि सहसंयुजी संयुगे
आयनिक संयुगे
- आयनिक बंध असलेल्या संयुगांना आयनिक संयुगे म्हणतात.
- ही संयुगे इलेक्ट्रॉन्सची देवाण – घेवाण होऊन तयार होतात
- इलेक्ट्रॉनची देवाणघेवाण धातू व अधातू मध्ये होते.
- आयनिक बंध मजबूत असतो.
- आयनिक संयुगाचा द्रवणांक उत्कलनांक उच्च असतो.
- आयनिक संयुगे सामान्यतः पाण्यात विरघळतात.
उदाहरण:
सहसंयुज संयुगे:
- सहसंयुज बंध असलेल्या संयुगांना सहसंयुज संयुगे म्हणतात.
- ही संयुगे इलेक्ट्रॉनची भागीदारी होऊन तयार होतात.
- इलेक्ट्रॉनची भागीदारी फक्त अधातूमध्ये होते.
- सहसंयुज बंध कमकुवत असतो.
- सहसंयुज संयुगांचा द्रवणांक व उत्कलनांक कमी असतो.
- सहसंयुज संयुगे सामान्यतः पाण्यात विरघळत नाहीत. परंतु केरोसीन, कार्बन डाय-सल्फाइड आणि मिथील बेंझीन यासारख्या सेंद्रिय द्रावणात विरघळतात.
उदाहरण
सहसंयुज बंधातील ध्रुवता
दोन अधातूंच्या अणूंमध्ये सहसंयुज बंध निर्माण होत असताना त्यातील सामाईक इलेक्ट्रॉनला स्वत:कडे आकर्षित करण्याच्या अणूच्या क्षमतेला त्या अधातू मूलद्रव्याची विद्युतऋणता असे म्हणतात. ज्या अधातूंच्या बाह्यतम कक्षेत जास्त इलेक्ट्रॉन त्याची विद्युतऋणता जास्त असते आणि ज्यांच्या बाह्यतम कक्षेत कमी इलेक्ट्रॉन त्यांची विद्युतऋणता कमी असते. विद्युतऋणतेच्या आधारे सहसंयुज बंधातील ध्रुवता निश्चित होते. त्यानुसार ध्रुवीय बंधाचे दोन प्रकार पडतात.
1) अध्रुवीय सहसंयुज बंध
समान अधातूमध्ये इलेक्ट्रॉनची भागीदारी झाल्यास त्यातील सामाईक इलेक्ट्रॉन दोन्ही अधातूंचे अणू सारख्याच प्रमाणात आकर्षून घेतात, कारण समान अधातूंची विद्युतऋणता सारखीच असते त्यांच्यातील बंधाला अध्रुवीय सहसंयुज बंध असे म्हणतात.
2) ध्रुवीय सहसंयुज बंध
दोन किंवा अधिक भिन्न अधातूंच्या अणूमध्ये इलेक्ट्रॉनची भागीदारी झाल्यास त्यामधील सामाईक इलेक्ट्रॉन ज्या अधातूची विद्युतऋणता जास्त असते त्याकडे जास्त प्रमाणात आकर्षित होतात तर दुसर्याकडे कमी प्रमाणात आकर्षित होतात. त्यामध्ये तयार होणाऱ्या बंधाला ध्रुवीय सहसंयुज बंध असे म्हणतात.
ज्या अधातूकडे सामाईक इलेक्ट्रॉन आकर्षित होतात त्या अधातूंवर अंशत: ऋण प्रभार तयार होतो तर दुसर्या अधातू वर अंशतः धन प्रभार तयार होतो.
अंशतः धन प्रभाराला डेल्टा प्लस तर अंशतः ऋणप्रभाराला डेल्टा मायनस या चिन्हाने दर्शवितात.
विचरण व आयनीभवन
1) विचरण
आयनिक संयुगे पाण्यात विरघळल्यानंतर त्यातील घटक आयन वेगळे होण्याच्या क्रियेला विचारण असे म्हणतात. आयन वेगळे होण्यासाठी लागणारी ऊर्जा द्रावकाकडून पुरविली जाते त्या ऊर्जेस ‘द्रावकीय ऊर्जा’ असे म्हणतात. जर द्रावक म्हणून पाण्याचा उपयोग केला असेल तर त्यातील द्रावकीय ऊर्जेला ‘जलीय ऊर्जा’ म्हणतात.
उदा: सोडियम क्लोराईड (मीठ) पाण्यात विरघळल्यास त्यातील धनप्रभारित आयन व ऋणप्रभारित आयन वेगळे होतात.
ज्या द्रावणांमध्ये मुक्त आयन असतात त्यातून विजेचे वहन होऊ शकते, त्यास विद्युत अपघटनी द्रावण असे म्हणतात. त्यामुळे शुद्ध पाणी विजेचे दुर्वाहक असते, परंतु मिठाचे जलीय द्रावण आयनांच्या अस्तित्वामुळे विजेचे सुवाहक बनते.
या द्रावणात मुक्त आयन नसतात त्यातून विजेचे वाहन होऊ शकत नाही, त्यास विद्युत अनपघटनी द्रावण असे म्हणतात.
उदाहरण: साखर, ग्लिसरिन, युरिया इत्यादी द्रावण
2) आयनीभवन
ध्रुवीय सहसंयुज बंध असलेल्या संयुगांमध्ये अंशतः आयनिक गुणधर्म असतात. अशी संयुगे पाण्यात विरघळल्यास त्यातील घटकांचे विभाजन होऊन आयनात रूपांतर होते या क्रियेस आयनीभवन म्हणतात.
उदा. हायड्रोजन क्लोराईड पाण्यात विरघळल्यास हायड्रोक्लोरिक आम्ल तयार होते. तेव्हा धनप्रभारित आयन व णप्रभारित आयन तयार होतात. त्यामुळेच शुध्द वायुरूप हायड्रोजन क्लोराईड विजेचे दुर्वाहक आहे, परंतु त्याचे जलीय द्रावण म्हणजे हायड्रोक्लोरिक आम्ल आयनांच्या अस्तित्वामुळे विजेचे सुवाहक बनते.
मूलके ( Radicals)
अणु किंवा अणूंचा समूह रासायनिक अभिक्रियेत एक किंवा अधिक इलेक्ट्रॉनची देवाण-घेवाण करून धन किंवा ऋण आयन तयार करतात त्यांनाच मूलके असे म्हणतात.
Table
मुलकांचे प्रकार
1) आम्लधर्मी मूलके:
सर्व ऋणप्रभारित मुलकांना आम्लधर्मी मूलके असे म्हणतात.
2) आम्लारीधर्मी मूलके:
सर्व धनप्रभारित मुलकांना आम्लारीधर्मी मूलके म्हणतात.
मुलकांचे प्रकार: (अणूच्या संख्येनुसार)
1) साधे मूलक (Simple Radicals) :
एकच अणू असलेल्या धन किंवा ऋण प्रभारित मुलकांना साधे मूलके म्हणतात.
2) संयुक्त मूल (Compound Radicals) :
दोन किंवा अधिक अणू असलेल्या धन /ऋण प्रभारित मुलकांना संयुक्त मूलके म्हणतात.